- 网站首页
-
走进协会
- 原料信息
- 金融服务
- 协会资讯
- 政策法规
- 行业资讯
- 相关下载
- 会员中心
化妆品新原料申报中,如何使用非动物测试方法?可豁免情形有哪些?
发布日期: 2023年09月07日 作者: 瑞欧科技化妆品原料的安全评估是成品安全评估的基础。在《植物原料如何申报化妆品新原料?一文解说(建议收藏)》中,我们介绍了中国化妆品新原料申报需要哪些毒理学资料。本篇我们将详细介绍,如何减少化妆品新原料中的动物测试,一起来看:
动物测试的替代需求,一方面,来自行业和消费者对于动物福利和“零残忍”的关注日益提高,推动法规立法重视动物试验的“减少(Reduction)、优化 (Refinement) 和替代 (Replacement)”。
另一方面,也是安全评估方法和毒理测试方法快速发展进步的结果。越来越多的国家和地区在化妆品的安全评价方面提出要使用动物替代方法,包括欧盟、美国、加拿大、挪威、澳大利亚等。
中国的替代方法不断扩充
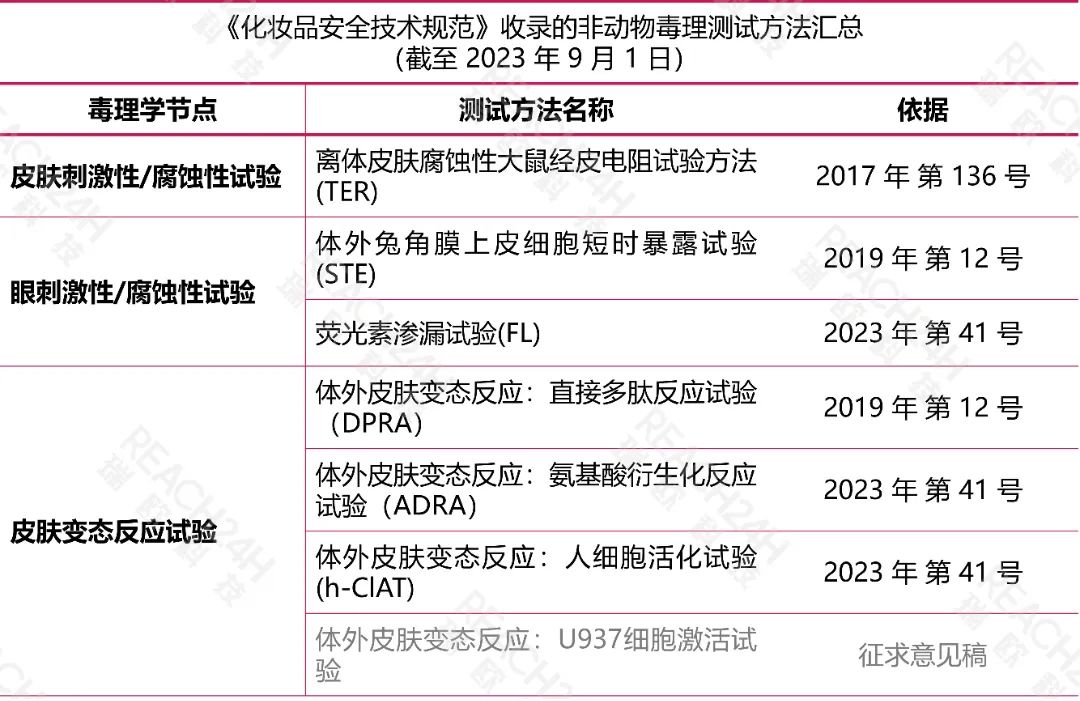
《化妆品安全技术规范》收录的替代方法正在不断扩充:
2021年第31号公告《化妆品新原料注册备案资料管理规定》(以下简称“规定”)中规定,有条件的接受动物替代方法。
化妆品新原料毒理学试验项目应当按照《化妆品安全技术规范》规定的试验方法开展。
目前,我国对化妆品新原料的申报资料要求仍以动物试验数据为主,但一直在积极推动化妆品替代试验研究与验证体系的建设,越来越多的动物替代方法被收录于《化妆品安全技术规范》。
在这里,我们对其中的非动物测试方法进行了汇总。

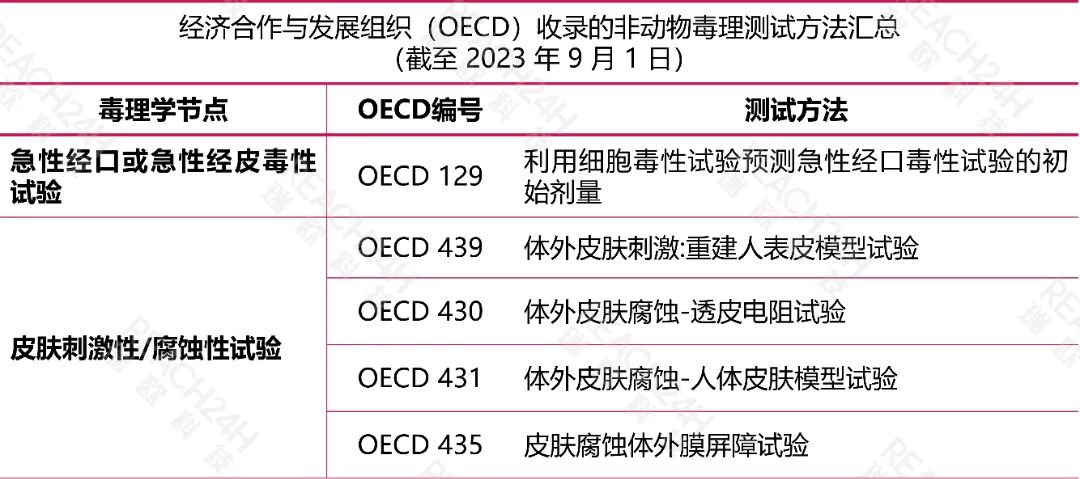
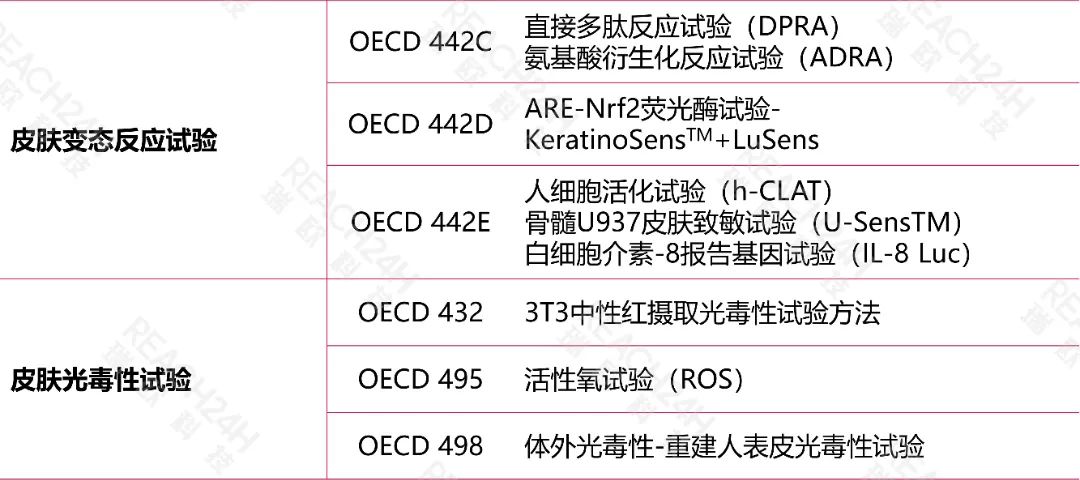
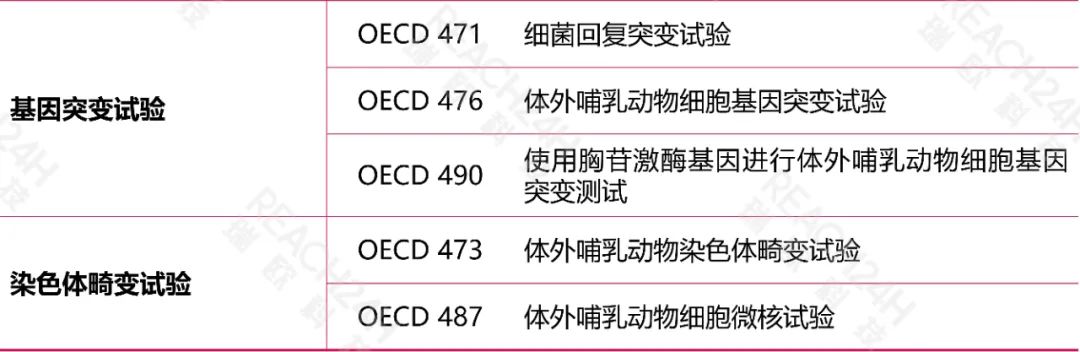
国际上的替代方法
《规定》要求应用的动物替代试验方法尚未收录于我国《化妆品安全技术规范》的,该项替代试验方法应当为国际权威替代方法验证机构已收录的方法,且应当同时提交该方法能准确预测该毒理学终点的证明资料。
证明资料应当包括该项替代试验方法研究过程简述和不少于 10 种已知毒性受试物的研究数据、结果分析、研究结论等内容。
国际权威替代方法验证机构主要包括:
经济合作与发展组织(OECD)
国际化妆品监管合作组织(ICCR)
美国替代方法验证跨部门协调委员会(ICCVAM)
欧盟动物试验替代方法参考实验室(EURL-ECVAM)
日本替代方法验证中心(JaCVAM)
韩国替代方法验证中心(KoCVAM)
加拿大卫生部(Health Canada)
...

可豁免动物试验的情形
什么情形的化妆品新原料有可能不开展动物试验完成申报?
对于化妆品新原料相关的毒理学试验,皮肤光变态反应试验国内外当前阶段仍无非动物试验替代方法。此外,关于系统毒性,都存在缺乏有效的替代方法的问题。
3种情形
基于上述原因,对于化妆品新原料申报,仅3种《规定》中的情形有可能不开展动物试验完成申报:
情形6:聚合物情形原料。
情形5 :具有安全食用历史的原料,且原料不具有紫外吸收特性。
情形3 :具有3年安全使用历史的低风险原料,且原料不具有紫外吸收特性,同时具有国际权威安全评价机构评价结论认为在化妆品中使用是安全的安全评估报告,或符合伦理学条件下的人体安全性检验报告。
方法适用性
此外,需注意,非动物试验替代方法均需结合方法的适用性,且大部分替代方法是细胞或者人造组织的测试,对于原料的组成和理化特定有要求,选择方法时需要注意。
比如:
OECD 129 :根据当前的研究该测试仅能作为预测急性经口毒性的初始剂量的替代方法;
OECD 491 体外兔角膜上皮细胞短时暴露试验 (STE):若受试物不能溶于或均匀混悬于生理盐水、5 % 的 DMSO / 生理盐水溶液或矿物油时不适用;
OECD 442C 体外皮肤变态反应:直接多肽反应试验,适用于单一组分(定量组成的物质,且其中一种主要成分含量至少 80 %(W/W))化妆品用化学原料或已知组成成分的多组分(定量组成的物质,且其中一种以上成分含量大于等于 10 %,小于 80 % )化妆品用原料。
整合测试策略
同时,单一的替代方法可能存在不足,必要时应采用整合测试策略(ITS)组合不同方法进行全面评估。
《规定》要求在化妆品新原料的注册备案过程中,使用动物替代方法进行毒理学安全性评价的,应当根据原料的结构特点、特定的毒理学终点选择合适的整合测试和评估方法(IATA)评价新原料的毒性。
比如:
眼刺激性/腐蚀性评价:目前常用的整合策略为自下而上(Bottom-Up)及自上而下(Top-Down)策略。
OECD 467推荐了以BCOP为核心方法的组合策略,规定性方法 1 (DAL-1) 为BCOP+RhCE, 规定性方法2 (DAL-2) 为 BCOP+STE。
皮肤致敏性评价:OECD 497推荐了3种评估策略,其中2o3策略是在导致皮肤致敏3个关键事件中选取至少2个开展。
包括KE1:蛋白质结合(DPRA);KE2:角化细胞活化(KeratinoSens™);KE3:树突状细胞激活(h-CLAT),是无需专家判断的方法。 以上就是对目前国内非动物测试方法的汇总,希望贯彻“零残忍”产品测试策略的企业,可以关注国内替代试验方法的更新进展,新测试方法的研究和建立需要行业的推动。
相关阅读友情链接政府网站中国政府网 国家药品监督管理局 国家市场监督管理总局 国家知识产权局 国家商务部 国家卫生健康委员会 国家海关总署 国家工业和信息化部 国家科学技术部 国家发展和改革委员会 国家统计局 省药品监督管理局 省市场监督管理局(知识产权局) 省卫生健康委员会 省工业和信息化厅 省科学技术厅 汕头市政府网 市市场监督管理局(知识产权局) 市工业和信息化局 市科学技术局 市商务局(口岸局) 市贸易促进委员会 市工商业联合会(总商会)相关网站版权所有 | 汕头市化妆品行业协会TEL:0754-88658188 | FAX:0754-88658122QQ:773788949 | E-mail:773788949@qq.com地址:汕头市龙湖区电信实业大厦1609室 | 邮编:515000备案号:粤ICP备20001656号
 @鑫煌科技@鑫嵘科技技术支持
@鑫煌科技@鑫嵘科技技术支持
- 原料信息
